
产品货号:
SY0822
中文名称:
高效T7 RNA体外合成试剂盒
英文名称:
Histan T7 High Yield RNA Synthesis Kit
产品规格:
50T|100T
发货周期:
1~3天
产品价格:
询价
本试剂盒使用T7 RNA聚合酶并以含有T7启动子序列的线型双链DNA为模板,以NTPs为底物,对启动子下游的DNA序列进行转录,高效合成单链RNA。转录时可在底物中加入修饰的核苷酸,制备生物素或染料标记的RNA。
本试剂盒可以合成长转录本以及短转录本,以1μg的模板投入量可以产生100~200μg的RNA,转录合成的RNA可用于诸如RNA结构与功能研究、RNA酶保护、探针杂交、RNAi、显微注射及体外翻译等多方面的下游应用。


图1.RNA体外转录过程

保存:-20℃,有效期2年。



相关搜索:高效T7 RNA体外合成试剂盒,T7体外转录试剂盒,T7 RNA体外转录试剂盒,Histan T7 High Yield RNA Synthesis Kit
本试剂盒可以合成长转录本以及短转录本,以1μg的模板投入量可以产生100~200μg的RNA,转录合成的RNA可用于诸如RNA结构与功能研究、RNA酶保护、探针杂交、RNAi、显微注射及体外翻译等多方面的下游应用。


图1.RNA体外转录过程

| 组分 | 50T | 100T |
| T7 RNA Polymerase Mix | 100μL | 200μL |
| 10×Transcription Buffer | 100μL | 200μL |
| ATP(100mM) | 100μL | 200μL |
| CTP(100mM) | 100μL | 200μL |
| GTP(100mM) | 100μL | 200μL |
| UTP(100mM) | 100μL | 200μL |
| Control DNA Template(500ng/μL) | 10μL | 20μL |
保存:-20℃,有效期2年。

- 反应体系中须严格注意不要混入RNase。
- 实验器材(如:枪头、产品管等)注意严格使用RNase Free用品。
- 为了您的安全和健康,请穿实验服并戴一次性手套操作。

- DNA模板制备
带有双链T7启动子的线性化质粒或PCR扩增产物都可以作为Histan T7 High Yield RNA Synthesis Kit体外转录模板,模板可以用TE缓冲液或Rnase free H2O溶解。
T7启动子序列:TAATACGACTCACTATAG*GG (注:G*为RNA转录的第一个碱基)- 质粒模板
将目的DNA插入含有T7启动子的质粒载体中,然后用限制酶进行处理,待完全线性化后进行纯化。
注:
① 环状质粒由于没有有效的终止,会转录出不同长度的RNA产物,为了得到特定长度的RNA,质粒必须完全线性化。
② 质粒线性化所选限制酶需要在启动子区域右侧、插入DNA片段的下游,且在插入DNA片段中无识别位点。选择的限制酶要能形成5’突出或者平滑末端。
③ 为了避免蛋白及盐离子等对体系的影响,质粒线性化后建议纯化后再作为模板进行体外转录。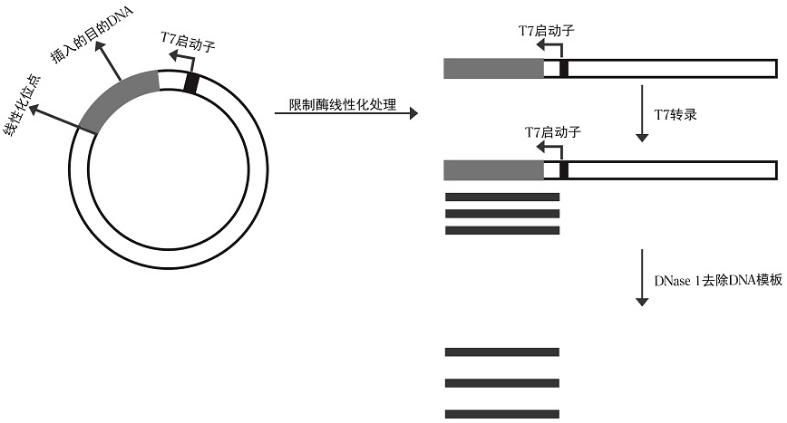
图2.线性化质粒为模板体外转录过程 - PCR产物模板
带T7启动子的PCR产物可以作为体外转录模板。首先将T7启动子序列(TAATACGA CTCACTATAGGG)加在有义链的上游引物的5’端,然后在高保真酶的作用下扩增含T7启动子的DNA模板,随后进行转录。PCR产物可以不经纯化直接作为模板,但纯化后会得到更高的RNA产出。
注:
① PCR产物作为模板,必须电泳确认产物的特异性及浓度,建议20μL反应体系投入2~5μL PCR产物。
② 为了得到更多高品质的RNA,推荐PCR产物胶回收之后再作为模板进行体外转录。
- 质粒模板
- RNA体外转录
- 试剂解冻
将T7 RNA Polymerase Mix短暂离心,置于冰上。解冻10×Transcription Buffer和核糖核苷酸(ATP、CTP、GTP、UTP),混匀并离心至管底,10×Transcription Buffer置于室温,4种核糖核苷酸置于冰上,备用。 - 室温装配转录反应
按下列体系配制反应体系成分 用量 终浓度 RNase-free H2O 至20μL - 10×Transcription Buffer 2μL 1× CTP/GTP/ATP/UTP (100mM each) 2μL 10mM each 模板DNA 1μg - T7 RNA Polymerase Mix 2μL -
注:
① 反应于室温配置。由于10×Transcription Buffer中含有亚精胺,低温下亚精胺浓度过高会引起DNA模板沉淀。
② 短转录本(<100nt),模板可使用2μg,转录时间增至4~8个小时。
③ 长转录本(>1000nt),建议使用质粒线性化模板进行转录。
④ 建议在PCR仪中进行反应,热盖打开,防止长时间导致反应液蒸发。
⑤ 反应产物可能有白色沉淀。这是反应过程中游离的焦磷酸与反应液中的镁离子形成焦磷酸镁,不影响后续实验。如想去除,添加EDTA即可消失。添加EDTA如果影响后续实验,也可以离心回收上清。
⑥ 使用试剂、容器等无RNase污染。 - 37℃孵育2个小时。
将上述反应液混合均匀,短暂离心至管底,37℃孵育2个小时。若转录本长度小于100nt,增加反应时间至4~8个小时。 - DNaseⅠ处理(可选)
反应完成后,每管加入2μL DNaseⅠ(RNase free),37℃孵育15min以去除模板DNA。
- 试剂解冻
- 产物纯化
转录后的RNA可以选用RNA Cleaner磁珠进行纯化,也可以采用酚/氯仿纯化法,氯化锂沉淀法或柱纯化等,以去除蛋白、游离的核苷酸。纯化后的RNA经电泳检测后可进行下游实验或存储于-80℃。- RNA Cleaner磁珠纯化法
提前将RNA clean beads从4℃取出,平衡至室温(约30min),并用RNase free H2O将转录产物稀释至50μL。
① 颠倒或涡旋振荡使磁珠充分混匀,吸取2×磁珠(100μL)加入RNA样品中(50μL),用移液器吹打6次充分混匀。室温孵育5min,使RNA结合到磁珠上。
② 将样品置于磁力架上5min,待溶液澄清后,小心移除上清。
③ 保持样品置于磁力架上,加入200μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 s,小心移除上清。重复此操作一次。
注:漂洗时使用的80%乙醇需要使用RNase free H2O新鲜配制,以防止引入RNase酶导致RNA降解。
④ 保持样品始终处于磁力架上,开盖空气干燥磁珠5min。
注:磁珠开盖晾干时要避免过分干燥,如果磁珠出现龟裂,则提示磁珠过分干燥,此时RNA的洗脱效率会降低。
⑤ 将样品从磁力架上取出,加入22μL RNase free H2O,用移液器吹打6次以充分混匀,室温静置5min。
⑥ 将样品置于磁力架5min,待溶液澄清后,小心转移上清20μL至一个新的RNase free PCR管中。
注:建议转移上清时留2~3μL液体,以免吸到磁珠影响后续实验。得到的RNA极不稳定,建议尽快进入下一步。若要保存,请置于-80℃保存。 - 酚/氯仿纯化法
①向20μL反应混合物中,加入115μL RNase free H2O和l5μL 3M乙酸钠(pH5.2),混合均匀。
②用等体积的酚/氯仿(1:1)抽提一次,再用等体积的氯仿抽提2次,收集上清,并转移至新的RNase free EP管中。
③加入2倍体积的无水乙醇沉淀RNA。混合均匀后置于-20℃至少30min,以最大转速,4℃离心15min,收集沉淀。
④加入500μL冰预冷的70%乙醇洗涤RNA沉淀。
⑤ 用20μL RNase free H2O溶解RNA沉淀。纯化后的RNA溶液于-80℃保存。 - 氯化锂沉淀法
采用氯化锂沉淀法,RNA长度要大于300nt,且浓度不能低于100ng/μL。
①向20μL反应混合物中,加入30μL RNase free H2O和30μL7.5M氯化锂。
②混合均匀后,置于-20℃至少30min,以最大转速,4℃离心15min,收集沉淀。
③加入500μL冰预冷的70%乙醇洗涤RNA沉淀。
④ 用20μL RNase free H2O溶解RNA沉淀。纯化后的RNA溶液于-80℃保存。 - 柱纯化法
纯化前加入80μL RNase free H2O将产物稀释至100μL,再按柱纯化说明书进行纯化。
- RNA Cleaner磁珠纯化法
- RNA定量
- 紫外吸收法
游离核苷酸会影响定量的准确性,采用此方法前请先进行RNA纯化。然后通过测定产物的A260读数来确定RNA的产量。对于单链RNA,1 A260相当于40μg/mL,所以RNA的产量可以如下计算:A260×稀释倍数×40 = μg/mL RNA - 染料法
用RiboGreen染料进行RNA定量,游离核苷酸不会影响定量,可以对纯化或未纯化的反应产物中的RNA进行准确定量。
- 紫外吸收法
- RNA大小及质量检测
- 琼脂糖电泳法
为了确定RNA的大小,完整度以及质量,需要进行琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳进行检测。 - Agilent 2100 Bioanalyzer检测法
2100可以用来评估RNA完整度及质量,它仅需要少量的RNA进行分析,高品质的RNA在电图上应呈现明显且锐利的峰。
- 琼脂糖电泳法

- 转录产物产量低
模板的质量与产量密切相关,实验组产量明显低于对照组,可能原因有:
① 实验模板中有抑制反应成分;
② 实验模板本身原因。
建议:
① 重新纯化模板;
② 确定模板定量以及其完整性;
③ 延长反应时间;
④ 加大模板投入量;
⑤ 尝试其它的启动子和RNA聚合酶。 - 短转录本产量低
转录起始片段短会抑制反应,转录产物小于100nt时,延长反应时间至4~8小时或增加模板量至2μg可以提高RNA产量。 - RNA转录长度大于预期
如果电泳显示产物条带大于预期大小,可能原因:
① 质粒模板可能没有完全线性化;
② 有义链3’端为突出结构;
③ RNA存在未完全变性的二级结构。
建议:
① 检查模板是否完全线性化,如有必要,额外进行线性化;
② 选择合适的限制性酶,避免产生3’突出端,或者用Klenow Fragment或T4 DNA聚合酶补齐后,再进行转录;
③ 使用变性胶检测RNA产物。 - RNA转录长度小于预期
如果电泳显示产物条带小于预期大小,可能原因:
① 模板包含类似于T7 RNA聚合酶的终止序列;
② 模板中GC含量高。
建议:
① 降低反应温度(比如,30℃),有时降低温度可以增加转录长度,但会降低产量。或者尝试不同的RNA聚合酶进行转录;
② 若模板GC含量高,采用42℃进行转录反应,或者添加SSB提高产量及转录长度。 - 转录产物电泳拖尾
电泳过程中有拖尾现象,可能原因:
① 实验操作过程被RNase污染;
② DNA模板被RNase污染。
建议:
① 实验过程中使用RNase-free的枪头和EP管,佩戴一次性乳胶手套和口罩,所有试剂均用RNase free H2O配制。
② 重新纯化模板DNA。
相关搜索:高效T7 RNA体外合成试剂盒,T7体外转录试剂盒,T7 RNA体外转录试剂盒,Histan T7 High Yield RNA Synthesis Kit



